ΤΟ ΑΤΟΜΟ ΤΟΥ ΥΔΡΟΓΟΝΟΥ
Το 1913 ο Δανός Φυσικός Niels Bohr έκανε γνωστή τη
θεωρία που είχε συνθέσει για να ερμηνεύσει τα
χαρακτηριστικά των ατομικών φασμάτων. Παρ' όλα τα
Κλασικά στοιχεία της θεωρίας του το μοντέλο
ατόμου του Bohr είχε μεγάλη επιτυχία, που οφείλεται
σε μερικά πραγματικά επαναστατικά αξιώματα:
- Το ηλεκτρόνιο περιφέρεται υπό την επίδραση της
δύναμης Coulomb σε κυκλικές τροχιές γύρω από το
πρωτόνιο.
- Μόνο μερικές τροχιές επιτρέπονται στις οποίες
το ηλεκτρόνιο δεν ακτινοβολεί. Επομένως η
ενέργεια του είναι σταθερή, και η κίνηση του
ηλεκτρονίου μπορεί να περιγραφεί με την κλασική
μηχανική.
Το ηλεκτρόνιο εκπέμπει ακτινοβολία
μόνο όταν μεταβαίνει από μια επιτρεπτή τροχιά σε
άλλη επιτρεπτή χαμηλότερης όμως ενέργειας. Η
συχνότητα του εκπεμπόμενου φωτονίου
(ακτινοβολία) συνδέεται με τη μεταβολή της
ενέργειας του ατόμου, σύμφωνα με τη σχέση Planck-Einstein:
Ei - Ef = h·f
όπου Ei και Ef οι ενέργειες της αρχικής
και τελικής κατάστασης του ατόμου αντίστοιχα.
- Οι επιτρεπτές τροχιές του ηλεκτρονίου καθορίζονται από μια πρόσθετη κβαντική
συνθήκη, η οποία ορίζει ότι επιτρεπτές είναι μόνο οι τροχιές εκείνες στις
οποίες η στροφορμή του ηλεκτρονίου γύρω από τον πυρήνα είναι ακέραιο πολλαπλάσιο
της σταθεράς του Planck h διαιρεμένης με το 2π,
το
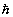 :
:
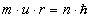
Το μοντέλο του Bohr εφαρμόζεται με επιτυχία στα παρόμοια με το Υδρογόνο άτομα,
όπως είναι το απλά ιοντισμένο Ήλιο και το διπλά ιοντισμένο Λίθιο. Ωστόσο δεν ερμηνεύει
ικανοποιητικά τα φάσματα των πιο πολύπλοκων ατόμων και ιόντων.
Δείτε το σχετικό εικονικό
πείραμα